添加日期:2016年1月4日 阅读:1619
医械圈内的人都知道第*类医械在医械圈内很吃香,因为国家2014年6月1日发布了《医疗器械监督管理条例》开始实施,将第*类医疗器械上市许可由原来的注册审批制改为备案制。也就是说凡是在《第*类医疗器械产品目录》内的第*类医疗器械只需要备案后即可上市,无需注册。这样就免除了注册费的成本。
2015年7月配套发布了《医疗器械分类规则》(国家食品药品监管总局令第15号),新分类将于2016年1月1日起施行,围绕一类目录及豁免临床的二类、三类产品,对结构组成、预期用途等都加上了较为具体和细致的描述,企业在使用目录时不能像过去仅从产品名称出发,而应从产品属性出发,即工程原理、分类规则的要素等,寻找产品在目录中的正确位置。
同时,CFDA还规定本规则自2016年1月1日起施行。2000年4月5日公布的《医疗器械分类规则》(原国家药品监督管理局令第15号)同时废止。
以下是按照新的《医疗器械分类规则》整理的分类判定表
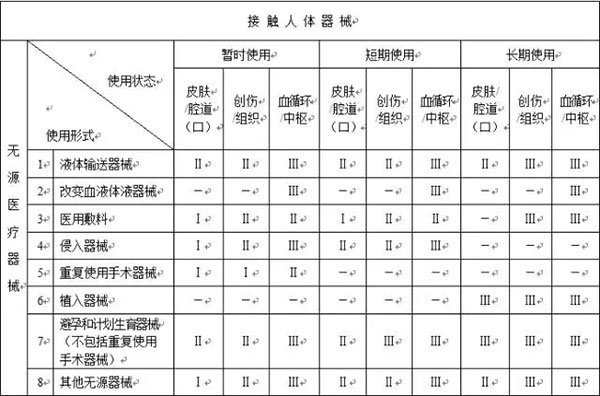
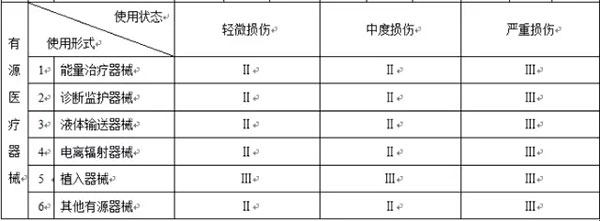
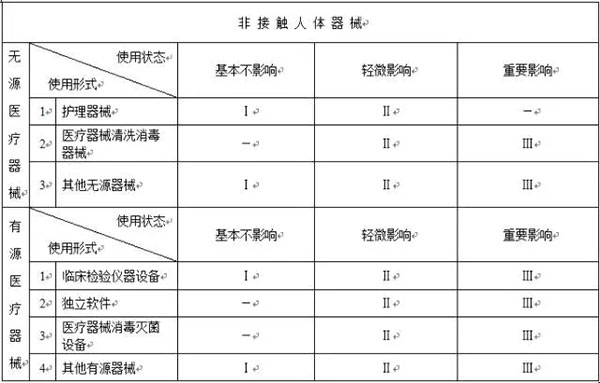
注:1.本表中“Ⅰ”、“Ⅱ”、“Ⅲ”分别代表第*类、第二类、第三类医疗器械;
2.本表中“-”代表不存在这种情形。
和之前的分类列表相比,大家可以看出:在接触人体医械中,一次性无菌外科器械被取消了,不在分为第*类医械;而在非接触人体医械中,体外诊断试剂被取消了,不会按照第*类医械管理,而医疗器械消毒灭菌设备也没有归类在第*类医疗器械中,也就是说这三类医械将不再享受备案后直接上市的福利。
文章来源:
1.凡本网注明“来源:1168医药招商网”的所有作品,均为广州金孚互联网科技有限公司-1168医药招商网合法拥有版权或有权使用的作品,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已经本网授权使用作品的,应在授权范围内使用,并注明“来源:1168医药招商网http://www.1168.tv”。违反上述声明者,本网将追究其相关法律责任。
2.本网转载并注明自其它来源(非1168医药招商网)的作品,目的在于传递更多信息,并不代表本网赞同其观点或和对其真实性负责,不承担此类作品侵权行为的直接责任及连带责任。
3.其他媒体、网站或个人从本网转载时,必须保留本网注明的作品第一来源,并自负版权等法律责任。
4.如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。联系邮箱:1753418380@qq.com。

【适用范围】用于缓解颈、肩、腰、腿及闭合性软组织疼痛、肿胀等不适症状人群的物理冷敷。【使用方法】外用。将本品适量直接涂抹于不适部位,轻轻按摩2-3分钟,每日2-3次。

【适用范围】用于缓解颈、肩、腰、腿及闭合性软组织疼痛、肿胀等不适症状人群的物理冷敷。【使用方法】外用。将本品适量直接涂抹于不适部位,轻轻按摩2-3分钟,每日2-3次。
 粤公网安备 44011102000390号
粤公网安备 44011102000390号